Aktuelles
Luzerner Arzt 129 / 2022
Update Prädiktion und Prävention der Präeklampsie
in der Frühschwangerschaft
J Kohl, S Ardabili, M Hodel, Perinatalzentrum Luzern
Einleitung
Heute ist es möglich, den grössten Teil der Fälle einer Präeklampsie (PE), die sich klinisch erst in der zweiten Schwangerschaftshälfte manifestiert und dann nur noch mittels Entbindung therapierbar ist, bereits in der 12. Schwangerschaftswoche (SSW) mit spezifischen Tests vorauszusagen. Entscheidend ist dabei, dass nicht nur eine Prädiktionsmöglichkeit der Präeklampsie, sondern auch eine effiziente Präventionsoption mittels niedrig dosierter Aspirin-Gabe ab dem ersten Trimester existiert. So lässt sich eine frühe schwere Präeklampsie in bis zu zwei Drittel der Fälle verhindern und es können viele schwere Kurz- und Langzeitfolgen für Mutter und Kind vermieden werden.
Die frühe Prädiktion einer Präeklampsie erfolgt am besten mit einer Kombination aus der Doppleruntersuchung der Aa. uterinae bds., einer standardisierten Blutdruckmessung, der Bestimmung plazentarer Biomarker und der Anamnese der Schwangeren. Daraus wird mit einem validierten Algorithmus das individuelle Risiko für die Schwangere berechnet. Ein Risiko grösser als 1:100 für die Entwicklung einer Präeklampsie vor der 37. Schwangerschaftswoche gilt als cut-off, bei welcher eine Aspirin-Prophylaxe sinnvoll ist.
Die Schweizerische Gesellschaft für Gynäkologie und Geburtshilfe (SGGG) hat auf die sehr gute Studiengrundlage der Präeklampsieprävention mit einer Leitlinie reagiert, dem Expertenbrief No. 57 (2). Diesen möchten wir zum Anlass nehmen, die Möglichkeit der Risikospezifizierung und Prophylaxe dieses schweren geburtshilflichen Krankheitsbilds vorzustellen und zu diskutieren.
Präeklampsie:
Definition und Überblick
Was der Volksmund als «Schwangerschaftsvergiftung» kannte, wurde früher in der Geburtshilfe als «EPH-Gestose» bezeichnet (E= Oedeme, P= Proteinurie, H = Hypertonus). Daraus resultiert im Gynäkologendeutsch bis heute die inkorrekte Gleichsetzung von «Gestose» mit einer Präeklampsie. Heute klassifiziert man die Präeklampsie als vielgestaltige, schwangerschaftsspezifische Multiorganerkrankung aus der Familie der «Hypertensiven Erkrankungen in der Schwangerschaft» (3).
2013 schloss sich das American College of Obstetricians and Gynecologists (ACOG) der Definition der Präeklampsie nach den Kriterien der International Society for the Study of Hypertension in Pregnancy (ISSHP) an (5). Diese Klassifikation hat sich seither durchgesetzt, wurde zuletzt 2018 revidiert (7) und berücksichtigt die unterschiedlichen Organmanifestationen des Krankheitsbildes (Tabelle 1).
Obligates Kriterium ist immer eine nach 20 SSW neu aufgetretene arterielle Hypertonie in Kombination mit einem Anzeichen einer anderen Organbeteiligung. Die Proteinurie ist noch in der Definition enthalten, jedoch kein obligates Kriterium mehr. Da periphere Oedeme bei ca. 80 – 90% der Schwangeren in hoher SSW auftreten und damit äusserst unspezifisch sind, wurde das Symptom der «E» mittlerweile aus der Definition entfernt.
Die Präeklampsie ist eine systemische Multiorganerkrankung in der Schwangerschaft. Das aktuelle Pathogenesekonzept
beschreibt primär ein gestörtes uterines vaskuläres Remodeling im 1. Trimenon als Hauptursache eines späteren Endzottenmangels der Plazenta und in dessen Folge wiederum eine durch plazentare Gewebsfaktoren (sFlt-1, Zytokine, freie Radikale) vermittelte endotheliale Dysfunktion bei der Mutter. In der Folge verschlechtert sich die Ratio von vasokonstriktorischen zu vasodilatativen Faktoren zu Ungunsten der arteriellen
Perfusion von Uterus und Plazenta.

Tabelle 1: Definition der Präeklampsie nach den revised ISSHP-Criteria (7)
In der Schweiz hat die Präeklampsie eine Inzidenz von ca. 2% entsprechend geschätzt 1800 – 1900 Fällen pro Jahr (2). Von diesen sind 25 – 40% «early-onset», d.h. sie entstehen vor 34 SSW. Eine Präeklampsie hat obligat die Tendenz sich ohne Entbindung zu verschlechtern und kann zu schweren maternalen Organmanifestationen wie einem HELLP-Syndrom, der Eklampsie mit möglichen schweren neurologischen Komplikationen, einem Nierenversagen oder kardiovaskulären oder hämatologischen Manifestationen führen. Erhöht ist auch die Rate an Small for gestational age-Feten (SGA) oder intrauteriner Wachstumsretardierung (IUGR). Eine Präeklampsie ist insbesondere bei Geburt vor der 34. SSW mit einer erhöhten neonatalen Morbidität und Mortalität assoziiert. Man geht geschätzt davon aus, dass die Präeklampsie für 25% der neonatalen Todesfälle weltweit verantwortlich ist, sei es durch die Notwendigkeit der iatrogenen Frühgeburtlichkeit bei maternaler Verschlechterung oder durch mit der IUGR assoziierte kindliche Problematiken. Eine erlebte Präeklampsie erhöht zudem markant das lebenszeitliche Risiko kardiovaskulärer Erkrankungen für die Mutter. Die einzige definitive Therapie der Präeklampsie bleibt die Entbindung.
Prävention der Präeklampsie
Die einzige «gute» Präeklampsie ist die verhinderte Präeklampsie. Frühere Präventionsmassnahmen wie Salzrestriktion, Bettruhe, Heparin, Magnesium, Selen, Fischöl oder Vitamin D haben keinen protektiven Effekt gezeigt (4,6). Ein mittlerweile sehr hohes Evidenzniveau untermauert als einzige effektive Methode die frühzeitige Gabe von low-dose Acetylsalicylsäure (ASS) in der Schwangerschaft mit Start vor der 16. SSW. Die Wirkweise von ASS ist dabei vielschichtig und letztlich nicht abschliessend geklärt. Das Medikament beeinflusst das bei Präeklampsie ungünstige Verhältnis zwischen Thromboxan A2 (TXA2, Plättchenaktivator und Vasokonstriktor) und Prostaglandin I2 (PGI2, Plättcheninhibitor und Vasodilatator) positiv. Die reduzierte Plättchenaggregation führt zu einer verbesserten Perfusion der Plazenta. Und zusätzlich verringert ASS in einer hypoxischen Plazenta die Expression von sFlt-1 (die lösliche Form des VEGFRezeptors) aus dem Trophoblast und hat so eine proangiogene Wirkung (8,9).
Die erste prospektive randomisierte Studie, die eine signifikante Reduktion von Präeklampsien durch ASS zeigte, stammt bereits von 1985 (10). Seither wurde der Effekt von ASS und die optimale klinische Anwendung in einer beträchtlichen Anzahl von Einzelstudien, Meta- Analysen und Cochrane-Studien untersucht. 2010 zeigte eine Meta-Analyse von 34 doppelblind randomisierten Studien von Bujold und Kollegen, dass bei Risikoschwangerschaften ein signifikanter protektiver Effekt von ASS besteht – jedoch nur dann, wenn die Gabe vor der 16. SSW initiiert wurde (11). Die bedeutendste Studie mit Nachweis einer signifikanten Reduktion der Präeklampsie war das ASPRE-Trial, welches 2017 im NEJM veröffentlicht wurde. In dieser prospektiven, doppelblind randomisierten Multicenterstudie wurden 1776 Risikoschwangere zu ASS 150 mg/d versus Placebo randomisiert (12). Dabei fand sich hoch signifikant eine Reduktion der Häufigkeit einer Präeklampsie vor 37 SSW («preterm preeclampsia») von 62%, für die seltenere Präeklampsie vor 34 SSW sogar um 82%. Das Besondere war dabei, dass das Risiko einer Schwangeren, eine Präeklampsie zu entwickeln, durch den weiter unten erklärten Algorithmus der Fetal Medicine Foundation (FMF London) bestimmt und mit einem Cutoff von 1:100 definiert worden war. Damit war der Nachweis geführt, dass durch ein Screening im 1. Trimester, welches anamnestische Faktoren, Dopplerwerte und maternale Serumbiochemie zu einem Algorithmus zusammenfasste, eine Prophylaxe einer klinisch für Mutter und Kind hochrelevanten Erkrankung effektiv möglich war.
Erfahrungen mit der Gabe von ASS in der Schwangerschaft sind sehr breit dokumentiert. ASS low-dose (81 – 150 mg/d) ist nicht teratogen und führt nicht zum gefürchteten frühzeitigen Verschluss des Ductus arteriosus Botalli, den antiphlogistische Dosen von ASS und anderer NSAR ab der 28. SSW verursachen können. Das antepartale Risiko für maternale Blutungen oder eine vorzeitige Plazentalösung ist unter low-dose ASS nicht erhöht, auch die Wahrscheinlichkeit einer postpartalen Hämorrhagie steigt gemäss Meta-Analyse (13) nicht an – auch wenn einzelne neuere Studien von einem moderat erhöhten postpartalen Blutungsrisiko berichten, wenn das Aspirin nicht wie empfohlen in der 36. SSW gestoppt wird.
Identifikation der Risikogruppe für Präeklampsie
Es gibt unverändert keine Rationale für die generelle Gabe von ASS in der Schwangerschaft. Daher stellt sich die Frage, wie am besten die Schwangere identifiziert werden kann, die von der frühzeitigen Einnahme von ASS profitieren würde.
Klassischerweise wurde das Risikoprofil einer Schwangeren anhand von anamnestischen Faktoren bestimmt. So empfehlen auch derzeit noch in den UK das National Institute for Healthcare and Excellence (NICE) (Tabelle 2) oder in den USA das ACOG den Einsatz von ASS zur Präeklampsie- Prophylaxe bei Vorhandensein bestimmter Risikofaktoren (4,6). Allein schon die klinische Erfahrung besagt aber, dass es auch die «vollständig gesunde junge Schwangere» gibt, die aus «heiterem Himmel » eine schwere frühe Präeklampsie entwickelt, ohne einen einzigen der klassischen anamnestisch zugänglichen Risikofaktoren gezeigt zu haben. Daher wurde nach unabhängigen Risikofaktoren gesucht, die im «window of opportunity» vor 16 SSW eine bessere Differenzierung des Risikoprofils erlauben würden. Es resultierte der von der FMF London erdachte Einbezug des dopplersonographisch gemessenen Widerstands der uterinen Arterien, des mütterlichen Blutdruckes und der im Serum der Mutter bestimmbaren plazentaren Faktoren wie PAPP-A und PlGF.
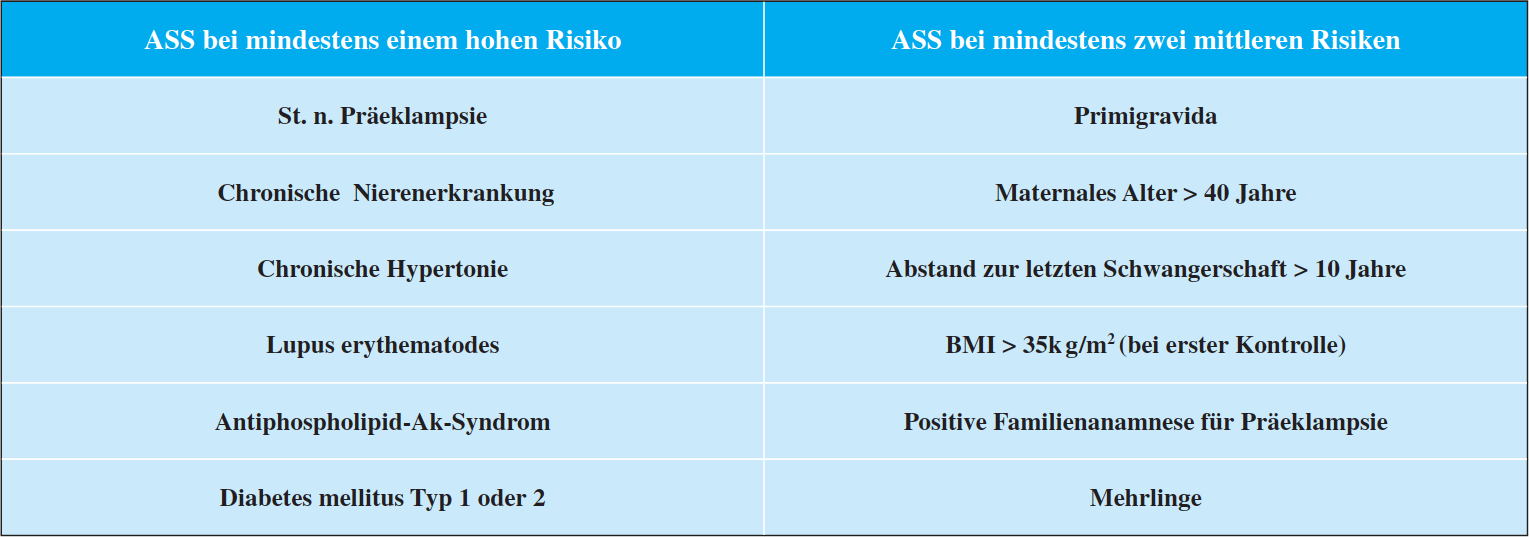
Tabelle 2: Beispiel Empfehlung zur ASS-Prophylaxe nach NICE rein nach Risikofaktoren (mit einer Detektionsrate von nur 41% für eine
Präeklampsie < 32 SSW und 39% < 37 SSW bei einer FPR von 10.2%)
Die FMF London entwickelte daraus ein Rechenmodell, das sich in der Prädiktion der Präeklampsie den anamnestischen Faktoren als überlegen herausgestellt hat. Bei einer Screen-positiv-Rate (SPR) von 10% können so annähernd 100% der Präeklampsien vor der 32. SSW und bis zu 75% der Präeklampsien vor der 37. SSW erkannt werden. Die Vergleichsraten nach den Anamnesekriterien der NICE bspw. betragen bei einer FPR von 10.2% nur 41% und 39% (2,8,9). Zusammenfassend ist damit der FMF-Algorithmus den NICE- und ACOG-Kriterien überlegen. Für die Prädiktion der Präeklampsien über der 37. SSW sind leider alle verfügbaren Prädiktionsmodelle nicht gut und nicht geeignet. Dies lässt darauf schliessen, dass die late-onset Präeklampsie (>34 SSW) trotz gleicher Entität einem anderen pathogenetischen Muster unterliegt als die frühe Form.
Die SGGG hat dieser Studienlage Rechnung getragen. Zur Empfehlung eines generellen Screenings konnte sich die Fachgesellschaft 2019 nicht entschliessen, bezeichnete aber die Risikoberechnung mittels Algorithmus der FMF London der rein anamnestischen Spezifizierung überlegen und den Effekt von ASS bei der Präeklampsie-Prophylaxe als signifikant. Bei einer Niedrigrisikosituation (genannt sei das Beispiel: Multipara, Einling, BMI normal, keine Präeklampsie in der Anamnese) gilt ein Screening nach FMF London gemäss SGGG als optional. Sehr bedeutsam ist die Anmerkung der SGGG, dass in Hochrisikosituationen (z.B. Status nach early-onset-Präeklampsie, maternalen Nierenerkrankungen oder dem Anti- Phospholipid-Antikörper-Syndrom) kein Screening nach FMF gemacht, sondern primär ASS gegeben werden sollte. Eine Risikokalkulation nach FMF London kann dabei an entsprechend qualifizierten und zertifizierten Zentren durchgeführt werden. Dies bedeutet letztlich, dass alle Schwangere früh über die Option des Screenings informiert werden müssen. Im internationalen Vergleich ist interessant, dass sich die FIGO (International Federation of Gynecology and Obstetrics) in ihrer Guideline von 2019 (14) darauf geeinigt hat, den Algorithmus der FMF London universell zu empfehlen, wobei in Ländern ohne Zugang zu Dopplerultraschall und Laboruntersuchen eine Spezifizierung des Risikos zumindest durch die Kombination des mütterlichen Blutdruckes mit anamnestischen Faktoren empfohlen wird.
Algorithmus der FMF London zur Spezifizierung des Präeklampsie-Risikos
Die Untersuchung erfolgt beim ersten frühen Organultraschall (1. Screening) zwischen der 11. und 14. SSW, analog einer Scheitel-Steiss-Länge (SSL) des Feten von 45 – 84mm. Nach einem standardisierten Messprotokoll wird auf Höhe des inneren Muttermundes lateral der Gebärmutter die A. uterina beidseitig transabdominal gedopplert und der arterielle Widerstand als Pulsatilitätsindex beider Seiten gemittelt (Bild 1).
Zusätzlich wird an beiden Armen der arterielle Blutdruck in Mehrfachmessung standardisiert bestimmt, bis eine annähernde Übereinstimmung der Ergebnisse verlässliche Ruhewerte anzeigt. Als proangiogener plazentarer Marker wird PlGF (Placental Growth Factor) im mütterlichen Serum gemessen. PlGF steigt zwischen der 8. und 14. SSW kontinuierlich an, bei Risikoschwangeren für eine Präeklampsie bleiben die Werte im Verlauf jedoch vergleichsweise tief. Diese Messparameter sowie das mütterliche Alter und die anamnestischen Faktoren werden in der Software der FMF London erfasst. Diese kalkuliert ausgehend vom anamnestisch definierten Hintergrundrisiko der Schwangeren die adjustierte Wahrscheinlichkeit für eine Präeklampsie. Gemäss ASPRE-Trial gilt ein Cutoff von 1:100 für eine Präeklampsie vor der 37. SSW als Indikation zur Prophy laxe mit ASS 100 – 150 mg 1x täglich p.o.. Die abendliche Einnahme ist dringend zu empfehlen, da ein chronobiologischer Wirkeffekt von ASS in kleineren Studien nachgewiesen werden konnte.

Bild 1: Beispiel einer korrekten Bestimmung des Pulsatilitätsindex (PI) der Arteria uterina in der 11. – 14. SSW nach FMF London: Paramediane Sagittalebene mit Sichtbarkeit von Uterus und Blase, Arteria uterina im Parametrium auf Höhe des inneren Muttermundes mit weniger als 30° Insonationswinkel angeschallt, pw-Gate von 2mm, Max. Flussgeschwindigkeit
> 60cm/sec, 3 Herzaktionen ausgewertet
Eine strikte Qualitäts kontrolle der Untersuchung erfolgt über mehrere Mechanismen:
• Dopplersonographie: Untersucher müssen entweder über die FMF London oder die SGUMGG (Schweizerische Gesellschaft für Ultraschall in der Medizin Sektion Gynäkologie und Geburtshilfe) für die korrekte Bestimmung des Pulsatilitätsindexes der Aa. uterinae zertifiziert sein. Dafür muss seitens der FMF einmal ein Theorieteil absolviert werden und jährlich anonymisiert drei Beispielbilder zur Prüfung eingereicht werden. Bereits geringe Abweichungen vom Messprotokoll, insbesondere Messungen zu weit distal im Aufzweigungsgebiet der A. uterina führen zu einem falsch tief gemessenen Widerstand.
• Blutdruckmessung: Nach den Kriterien der National Heart Foundation of Australia wird sitzend nach einer Ruhephase von mindestens 5 Minuten mit der korrekten Manschettengrösse auf Herzhöhe bilateral der Blutdruck mehrfach gemessen, bis der systolische bzw. diastolische Blutdruck sich um weniger als 10 bzw. 6mmHg unterscheiden. Aus je zwei solcher Messwerte jeder Seite wird der mittlere arterielle Blutdruck (MAP) berechnet. Die Europäische Gesellschaft für Hypertonie (ESH) hat Standards festgelegt, wie ein Messgerät validiert werden soll. Die Verwendung eines solchen Gerätes und seine regel mässige Kalibrierung wird sehr empfohlen. Auf den Homepages der ESH oder der Schweizerischen Gesellschaft für Hypertonie (SGH/SSH) finden sich Listen mit entsprechend geeigneten Geräten. Eine manuelle Blutdruckmessung wird nicht akzeptiert.
• Einheitliche Labormessungen: Für die Bestimmung des PlGF und die Berechnung dessen MoM-Wertes sind vier Laborverfahren untersucht und zertifiziert (Kryptor von Brahms, Delfia-Systeme von PerkinElmer, Elecsys und Cobas E von Roche). Schwangere, bei denen das PlGF ab der 11. SSW nicht adäquat ansteigt, haben ein deutlich erhöhtes Risiko, eine Präeklampsie zu erleben. Das erklärt, dass erst ab der 11. SSW die Höhe des PlGF im maternalen Serum eine Differenzierung der Präeklampsie- Wahrscheinlichkeit erlaubt und eine frühere Bestimmung keinen Sinn ergeben würde.
Kritische Diskussion der optimalen Risikospezifizierung.
• In den Fachgesellschaften wurde teils argumentiert, dass nicht gesichert sei, ob die Resultate der grossen Studien zur Präeklampsie-Prophylaxe auf die Population in der Schweiz übertragbar sei, da z.B. eine demographisch unterschiedliche Zusammensetzung der Kollektive unterschiedliche Normwerte für Doppler- und Serumwerte bedeuten könnten. Zur Überprüfung dieser Fragestellung wurde in der Schweiz eine Registerstudie ins Leben gerufen (IPSISS-Studie), welche die Ergebnisse des Präeklampsie- Screenings nach FMF mit dem Outcome der Schwangeren abgleicht. Dabei fand sich in einer ersten Auswertung von über 1000 Screenings an den Geburtszentren des Inselspitals Bern, des Basler Universitätsspitals und der Frauenklinik Luzern eine exzellente Übereinstimmung der Ergebnisse im Schweizer Kollektiv mit den internationalen Studien (unpublished data). Diese Registerstudie läuft nun unter Einschluss mehrerer Schweizer Zentren – und auch fortgesetzt an der Frauenklinik Luzern – weiter mit dem Ziel, für eine noch präzisere Bestätigung insgesamt 10‘000 Schwangere mit Präeklampsie-Screening einschliessen zu können.
• Bisher ist die Datenlage am besten für die Risikospezifizierung und den Effekt der ASS-Prophylaxe bei einer Einlingsschwangerschaft. Der FMF Algorithmus ist jedoch auch für Zwillingsschwangerschaften anwendbar, die zugrunde liegenden Daten haben aber ein tieferes Evidenzniveau.
• Ungelöst ist weiterhin die Vergütung des Dopplerultraschalles und des Biomarkers PlGF (86 Taxpunkte). Eine Arbeitsgruppe der Akademie für fetomaternale Medizin (AFMM Schweiz) ist in Verhandlungen mit dem BAG, um diese beiden Leistungen in Zukunft über KLV abrechnen zu können. Die Ultraschalluntersuchung der A. uterina kann aktuell nicht verrechnet werden. Die Kosten-Effektivität des Screenings und der Gabe von ASS gilt aber bereits als erwiesen (Übersicht bei (9)). Niedrigen Kosten für Risikospezifizierung und Medikation stehen deutliche Ersparnisse bei stationären (Intensiv-) Behandlungen von Mutter und Kind gegenüber.
• Die Number needed to treat (NNT) für die Verhinderung eines unerwünschten Ereignisses durch FMF-Algorithmus und ASS-Einnahme vor 16 SSW beträgt nach der Kalkulation der Arbeitsgruppe von Rolnik und Nicolaides 38 zur Verhinderung einer Präeklampsie vor 37 SSW, 69 zur Verhinderung einer Präeklampsie vor 34 SSW, 51 um einen Aufenthalt auf der neonatalen Intensivstation von länger als 14 Tagen zu verhindern und 34 um einen intrauterinen Fruchttod zu verhindern (Übersicht bei (9)). Es wurde daher von manchen Seiten kritisch hinterfragt, ob diese relativ hohe NNT ein Screening rechtfertigen würde. Die Schwangerenbetreuung ist angesichts der hier besonders gravierenden Folgen einer Komplikation nach dem Prinzip der maximalen Risikominimierung ausgerichtet. In der Abwägung der hohen möglichen maternalen und neonatalen Morbidität durch eine Präeklampsie zum sehr geringen UAW-Profil von ASS dürften somit die genannten NNTs als klares Argument für die Risikospezifizierung gelten.
• Zudem hat sich gezeigt, dass durch den Algorithmus nicht nur mehr Frauen korrekt als Risikoschwangere identifiziert werden konnten, sondern dass bei sehr guten negativ-prädiktiven Werten gleichzeitig auch mehr Frauen mit klassischen anamnestischen Risikofaktoren korrekt als low-risk identifiziert wurden und demnach kein ASS einnehmen mussten. So kann eine relevante Anzahl Schwangerer dank genauerer Risikospezifizierung auch beruhigende Informationen erhalten. Und genau dies wiederum bedeutet das Prinzip des «turning the pyramid of care» (1): durch gezielte Untersuchungen zu Beginn der Schwangerschaft eine Vielzahl ungezielter und letztlich nicht indizierter Kontrollen in höherer SSW zu vermeiden.
Zusammenfassung
• Die Präeklampsie ist eine für Morbidität und Mortalität von Mutter und Kind hochgradig relevante schwangerschaftsspezifische Erkrankung und häufige Ursache der Frühgeburtlichkeit.
• Bereits im 1. Trimester – und nur dann – gibt es eine Option für eine Primärprophylaxe.
• Mit der prophylaktischen Gabe von 100 – 150 mg ASS 1x täglich abends bis in die 36. SSW und bei Beginn vor der 16. SSW lässt sich für Schwangere mit einem individuell hohen Präeklampsierisiko die Rate an frühen Präeklampsien – der gefährlichsten Form für Mutter und Kind – signifikant reduzieren. Die Rate der späten Präeklampsien jenseits der 37. SSW wird durch ASS nicht beeinflusst.
• Die SGGG weist seit 2019 zur Identifikation von Risikoschwangeren explizit darauf hin, dass der Algorithmus nach der FMF London der herkömmlichen Einschätzung nach anamnestischen Risikofaktoren signifikant überlegen ist und dass die Schwangere dazu informiert werden soll.
• Der FMF-Algorithmus zur Risikospezifizierung einer Präeklampsie in der 11. – 14. SSW beinhaltet die Berücksichtigung maternaler anamnestischer Faktoren PLUS die Bestimmung von PlGF im maternalen Serum, die Messung des arteriellen Mitteldrucks und die dopplersonographische Bestimmung des Widerstands in beiden Aa. uterinae.
• Verglichen mit einer konventionellen Screeningmethode, die allein auf klassischen maternalen Risikofaktoren beruht, lassen sich so in geschulten Händen signifikant mehr Schwangere identifizieren, die von einer Prophylaxe in der Schwangerschaft profitieren und das Risiko von frühen Präeklampsien um 70% reduzieren.
Literatur
beim Autor
Autoren / Kontakt markus.hodel@luks.ch



Dr. med.
Joachim Kohl
Leitender Arzt
Leiter Pränataldiagnostik
Luzerner Kantonsspital
Dr. med.
Sara Ardabili
Oberärztin
Fellow
Fetomaternale Medizin
Luzerner Kantonsspital
KD Dr. med.
Markus Hodel
Chefarzt
Geburtshilfe und
Fetomaternale Medizin
Luzerner Kantonsspital
